Sкандијум, са симболом елемента Sc и атомским бројем 21, лако се раствара у води, може да реагује са топлом водом и лако потамни на ваздуху. Његова главна валенца је +3. Често се меша са гадолинијумом, ербијумом и другим елементима, са ниским приносом и садржајем од приближно 0,0005% у кори. Скандијум се често користи за израду специјалног стакла и лаких легура отпорних на високе температуре.
Тренутно, доказане резерве скандијума у свету износе само 2 милиона тона, од чега се 90~95% налази у рудама боксита, фосфорита и гвожђа и титанијума, а мали део у рудама уранијума, торијума, волфрама и ретких земних елемената, углавном распрострањених у Русији, Кини, Таџикистану, Мадагаскару, Норвешкој и другим земљама. Кина је веома богата ресурсима скандијума, са огромним минералним резервама везаним за скандијум. Према непотпуним статистикама, резерве скандијума у Кини износе око 600.000 тона, које се налазе у налазиштима боксита и фосфорита, налазиштима порфирног и кварцног волфрама у Јужној Кини, налазиштима ретких земних елемената у Јужној Кини, налазиштима ретких земних елемената гвожђа Бајан Обо у Унутрашњој Монголији и налазиштима ванадијум титанијум магнетита Панџихуа у Сечуану.
Због оскудице скандијума, цена скандијума је такође веома висока, а на свом врхунцу, цена скандијума је била надувана до 10 пута веће од цене злата. Иако је цена скандијума пала, она је и даље четири пута већа од цене злата!
Откривање историје
Године 1869, Мендељејев је приметио разлику у атомској маси између калцијума (40) и титанијума (48) и предвидео да овде постоји и неоткривени елемент средње атомске масе. Предвидео је да је његов оксид X ₂ O Å. Скандијум је 1879. године открио Ларс Фредерик Нилсон са Универзитета у Упсали у Шведској. Екстрактовао га је из рудника црног ретког злата, сложене руде која садржи 8 врста металних оксида. Екстрактовао је...Ербијум(III) оксидод црне ретке златне руде и добијенеИтербијум(III) оксидиз овог оксида, а постоји и други оксид лакшег елемента, чији спектар показује да је у питању непознати метал. Ово је метал који је предвидео Мендељејев, чији је оксидSc₂O₃Сам метал скандијум је произведен одСкандијум хлориделектролитичким топљењем 1937. године.
Мендељејев
Електронска конфигурација
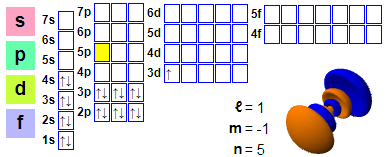
Електронска конфигурација: 1s² 2s² 2p6 3s² 3p6 4s² 3d1
Скандијум је меки, сребрно-бели прелазни метал са тачком топљења од 1541 ℃ и тачком кључања од 2831 ℃.
Током значајног периода након његовог открића, употреба скандијума није била демонстрирана због његове тешкоће у производњи. Са све већим побољшањем метода раздвајања ретких земних елемената, сада постоји зрео процес за пречишћавање једињења скандијума. Пошто је скандијум мање алкалан од итријума и лантанида, хидроксид је најслабији, тако да ће мешани минерал ретких земних елемената који садржи скандијум бити одвојен од ретких земних елемената методом „степеног таложења“ када се скандијум(III) хидроксид третира амонијаком након што је пребачен у раствор. Друга метода је одвајање скандијум нитрата поларним разлагањем нитрата. Пошто се скандијум нитрат најлакше разлаже, скандијум се може одвојити. Поред тога, свеобухватно опорављање пратећег скандијума из уранијума, торијума, волфрама, калаја и других минералних наслага је такође важан извор скандијума.
Након добијања чистог једињења скандијума, оно се претвара у ScCl Å и топи заједно са KCl и LiCl. Растопљени цинк се користи као катода за електролизу, што узрокује таложење скандијума на цинковој електроди. Затим се цинк испарава да би се добио метални скандијум. То је лагани сребрно-бели метал са веома активним хемијским својствима, који може реаговати са врућом водом и стварати водоник. Дакле, метални скандијум који видите на слици је затворен у боци и заштићен аргоном, иначе ће скандијум брзо формирати тамно жути или сиви оксидни слој, губећи свој сјајни метални сјај.
Апликације
Индустрија расвете
Употреба скандијума је концентрисана у веома светлим правцима, и није претеривање назвати га Сином светлости. Прво магично оружје скандијума назива се скандијум-натријумова лампа, која се може користити за осветљавање хиљада домаћинстава. То је метал-халидна електрична лампа: сијалица је напуњена натријум-јодидом и скандијум-тријодидом, а скандијум и натријумова фолија се додају истовремено. Током високонапонског пражњења, јони скандијума и јони натријума, респективно, емитују светлост својих карактеристичних таласних дужина емисије. Спектралне линије натријума су 589,0 и 589,6 nm, две познате жуте светлости, док су спектралне линије скандијума 361,3~424,7 nm, низ емисија блиске ултраљубичасте и плаве светлости. Пошто се међусобно допуњују, укупна произведена боја светлости је бела светлост. Управо зато што скандијум-натријумске лампе имају карактеристике високе светлосне ефикасности, добре боје светлости, уштеде енергије, дугог века трајања и јаке способности разбијања магле, могу се широко користити за телевизијске камере, тргове, спортске објекте и осветљење путева, и познате су као извори светлости треће генерације. У Кини се ова врста лампе постепено промовише као нова технологија, док се у неким развијеним земљама ова врста лампе широко користила већ почетком 1980-их.
Друго магично оружје скандијума су соларне фотонапонске ћелије, које могу да сакупљају светлост распршену по земљи и претварају је у електричну енергију за погон људског друштва. Скандијум је најбољи баријерни метал у металним изолаторима, полупроводничким силицијумским соларним ћелијама и соларним ћелијама.
Његово треће магично оружје назива се извор γ A зрака. Ово магично оружје може јако да сија само по себи, али ову врсту светлости не можемо да примимо голим оком, већ је то ток фотона високе енергије. Обично из минерала екстрахујемо 45Sc, што је једини природни изотоп скандијума. Свако језгро 45Sc садржи 21 протон и 24 неутрона. 46Sc, вештачки радиоактивни изотоп, може се користити као извор γ зрачења или као трасерски атоми који се такође могу користити за радиотерапију малигних тумора. Постоје и примене попут итријум-галијум-скандијум-гранат ласера.Скандијум флуоридСтаклено инфрацрвено оптичко влакно и катодна цев обложена скандијумом на телевизији. Изгледа да се скандијум рађа са сјајем.
Индустрија легура
Скандијум у свом елементарном облику се широко користи за допирање легура алуминијума. Чим се алуминијуму дода неколико хиљадитих делова скандијума, формираће се нова фаза Al3Sc, која ће играти улогу метаморфозе у легури алуминијума и значајно променити структуру и својства легуре. Додавање 0,2%~0,4% Sc (што је заиста слично пропорцији додавања соли прженом поврћу код куће, потребно је само мало) може повећати температуру рекристализације легуре за 150-200 ℃ и значајно побољшати чврстоћу на високим температурама, структурну стабилност, перформансе заваривања и отпорност на корозију. Такође може избећи феномен кртости који се лако јавља током дуготрајног рада на високим температурама. Алуминијумске легуре високе чврстоће и високе жилавости, нове заварљиве легуре алуминијума високе чврстоће отпорне на корозију, нове легуре алуминијума високе чврстоће отпорне на неутронско зрачење итд., имају веома атрактивне развојне перспективе у ваздухопловству, авијацији, бродовима, нуклеарним реакторима, лаким возилима и брзим возовима.
Скандијум је такође одличан модификатор за гвожђе, а мала количина скандијума може значајно побољшати чврстоћу и тврдоћу ливеног гвожђа. Поред тога, скандијум се може користити и као адитив за легуре волфрама и хрома отпорне на високе температуре. Наравно, поред израде венчанице за друге, скандијум има високу тачку топљења и густину сличну алуминијуму, а користи се и у лаганим легурама високе тачке топљења као што су легура титанијума скандијума и легура магнезијума скандијума. Међутим, због високе цене, генерално се користи само у висококвалитетним производним индустријама као што су свемирски шатлови и ракете.
Керамички материјал
Скандијум, једна супстанца, генерално се користи у легурама, а његови оксиди играју важну улогу у керамичким материјалима на сличан начин. Тетрагонални цирконијум керамички материјал, који се може користити као електродни материјал за горивне ћелије са чврстим оксидима, има јединствено својство где се проводљивост овог електролита повећава са повећањем температуре и концентрације кисеоника у околини. Међутим, кристална структура овог керамичког материјала сама по себи не може стабилно да постоји и нема индустријску вредност; неопходно је допирање неким супстанцама које могу да фиксирају ову структуру како би се одржала њена оригинална својства. Додавање 6~10% скандијум оксида је попут бетонске структуре, тако да се цирконијум може стабилизовати на квадратној решетки.
Постоје и инжењерски керамички материјали као што је силицијум нитрид високе чврстоће и отпоран на високе температуре као згушњивачи и стабилизатори.
Као средство за згушњавање,Скандијум оксидМоже формирати ватросталну фазу Sc2Si2O7 на ивици финих честица, чиме се смањује деформација инжењерске керамике на високим температурама. У поређењу са другим оксидима, може боље побољшати механичка својства силицијум нитрида на високим температурама.
Каталитичка хемија
У хемијском инжењерству, скандијум се често користи као катализатор, док се Sc2O3 може користити за дехидратацију и деоксидацију етанола или изопропанола, разградњу сирћетне киселине и производњу етилена из CO и H2. PtAl катализатор који садржи Sc2O3 је такође важан катализатор за процесе пречишћавања и рафинирања тешких уља хидрогенацијом у петрохемијској индустрији. У реакцијама каталитичког крековања као што је кумен, активност Sc-Y зеолитног катализатора је 1000 пута већа од активности алуминијум силикатног катализатора; у поређењу са неким традиционалним катализаторима, изгледи за развој скандијумских катализатора биће веома светли.
Нуклеарна енергетска индустрија
Додавање мале количине Sc2O3 у UO2 у нуклеарном гориву реактора високе температуре може спречити трансформацију решетке, повећање запремине и пуцање изазване конверзијом UO2 у U3O8.
Горивна ћелија
Слично томе, додавање 2,5% до 25% скандијума у никл-алкалне батерије ће повећати њихов век трајања.
Пољопривредни узгој
У пољопривреди, семе попут кукуруза, репе, грашка, пшенице и сунцокрета може се третирати скандијум сулфатом (концентрација је генерално 10⁻³ ~ 10⁻⁶ mol/L, различите биљке ће имати различите концентрације), а стварни ефекат подстицања клијања је постигнут. Након 8 сати, сува тежина корена и пупољака се повећала за 37% и 78% респективно у поређењу са садницама, али механизам се још увек испитује.
Од Нилсенове пажње посвећене дугу података о атомској маси до данас, скандијум је ушао у људски вид тек сто или двадесет година, али је готово сто година седео на клупи. Тек снажан развој науке о материјалима крајем прошлог века донео му је виталност. Данас су реткоземни елементи, укључујући скандијум, постали вруће звезде у науци о материјалима, играјући стално променљиве улоге у хиљадама система, доносећи више погодности у наше животе сваког дана и стварајући економску вредност коју је још теже измерити.
Време објаве: 29. јун 2023.